问题
填空题
(6分)某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20ml恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值和A值:Z , A 。
(2)X元素在周期表中的位置是第_______周期______族。
(3)把X的单质放入水中,写出反应的化学方程式 。
答案
(1)20;40 (2)第四周期第ⅡA (3)Ca+2H2O=Ca(OH)2+H2↑
反应的离子方程式为Cl-+Ag+=AgCl↓,所以氯离子的物质的量是1mol/L×0.02L=0.02mol,则氯化物的物质的量是0.01mol,所以相对分子质量是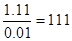 ,则X的质量数是111-35.5×2=40。又因为这种同位素原子核内有20个中子,所以质子数是20,是钙元素。属于活泼的金属,和水反应生成氢氧化钙和氢气。
,则X的质量数是111-35.5×2=40。又因为这种同位素原子核内有20个中子,所以质子数是20,是钙元素。属于活泼的金属,和水反应生成氢氧化钙和氢气。

