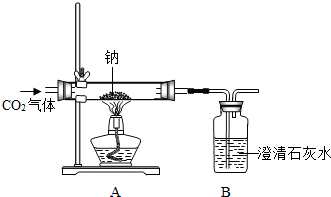
某化学课外兴趣小组为探究Na与CO2的反应进行了如下实验(实验部分装置如右图所示):向盛有Na的装置A中通入纯净、干燥的CO2,当观察到装置B中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后装置A中有黑色固体和白色固体生成.
【资料卡】
(1)K、Ca、Na等活泼金属的氧化物均可与水反应生成对应的碱;
(2)钠为银白色金属,过氧化钠(Na2O2)为淡黄色固体.
【提出问题】白色固体含有什么物质?
【猜想与假设】
假设1:白色固体是一种纯净物,仅含有______;
假设2:白色固体是一种混合物,含有Na2CO3和Na2O;
【实验设计】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量白色固体放入足量水中 | 白色固体完全溶解 | |
| ②取①中少量溶液,加入______. | 产生大量气泡 | 假设1成立 |
| ③另取①中少量溶液,______ ______ | ______ ______ | 假设2成立 |
Na在CO2中燃烧存在多个反应、生成多种物质.若假设1成立,请写出Na在CO2中燃烧的化学方程式:______.
【猜想与假设】根据质量守恒定律,反应物中含有钠元素、氧元素、碳元素,所以假设1:白色固体含有碳酸钠;
【实验设计】②因为现象是“产生大量的气泡”,所以是碳酸钠和盐酸的反应发生了;③假设2成立,因此加入足量的氯化钙溶液,产生白色沉淀,用氯化钙把碳酸钠消耗完后,剩余的氯化钙溶液显中性,剩余的氧化钠会与水生成对应的碱,即氢氧化钠,溶液显碱性,所以加入2~3滴酚酞试液,溶液呈红色;
【反思提高】Na在CO2中燃烧生成碳酸钠和碳,反应的化学方程式是4Na+3CO2
2Na2CO3+C. 加热 .
故答案为:假设1:Na2CO3;
【实验设计】
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量白色固体放入足量水中 | 白色固体完全溶解 | |
| ②取①中少量溶液,加入足量稀盐酸 | 产生大量气泡 | 假设1成立 |
| ③另取①中少量溶液,加入足量的氯化钙溶液,充分反应后过滤,再取少量滤液,向滤液中加入2~3滴酚酞溶液. | 产生白色沉淀 溶液由无色变成红色 | 假设2成立 |
| ||
