(10分)下表是元素周期表中的一部分。
| 族 周 期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | E | F | H | J | ||||
| 3 | B | C | D | G | I |
(1)化学性质最不活泼的元素是 ,氧化性最强的单质是 。
(2)最高价氧化物对应的水化物中,碱性最强的是 ,酸性最强的是 ,呈两性的是 。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是 。
(4)在B、C、D、G、I中,原子半径最大的是 。
(5) 元素C与I形成的化合物的电子式的形成过程是: 。
(1)Ne F2 (各1分,共2分)
(2) NaOH HClO4 Al(OH)3(各1分,共3分)
(3)HF(1分) (4)Na(1分)
(5)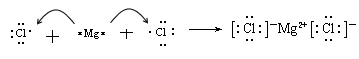 (2分)
(2分)
考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,A—J分别是H、Na、Mg、Al、C、N、S、F、Cl、Ar。
(1)稀有气体的原子的最外层电子数已经达到稳定结构,所以化学性质最不活泼。氟是最强的非金属元素,所以单质氟的氧化性最强。
(2)金属性越强,最高价氧化物的水化物的碱性越强,所以是氢氧化钠。非金属性越强,最高价氧化物的水化物的酸性越强。由于氟没有含氧酸,因此是高氯酸。氢氧化铝是两性氢氧化物。
(3)非金属性越强,相应氢化物的稳定性越强,所以是HF。
(4)同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,所以钠的原子半径最大。
(5)镁是活泼的金属,氯是活泼的非金属,二者形成的化学键是离子键,其形成过程可表示为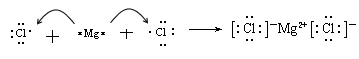 。
。
