(11分) A、B、C、D、E、F六种元素,它们的核电荷数均小于18,且原子序数逐渐增大。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。11.5g A单质恰好与100mL 5mol/L的盐酸完全反应,反应后溶液呈中性。D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个。请回答下列问题:
(1)D的元素符号 ,E的最高价氧化物的水化物的分子式 。
(2)画出B元素的原子结构示意图 。
(3)若构成F元素的一种原子的质量数为35,写出其原子符号 ,它原子核内的中子数是 。
(4)A与F、C与F、A与C元素最高价氧化物的水化物反应的离子方程式依次
为: 、 、 。
(11分)(1)Si H3PO4 (2)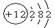
(3)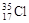 18
18
(4)H++OH- = H2O Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH- = AlO2-+2H2O
三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,说明一定含有铝元素。根据原子序数大小顺序可知,C是铝,A是第IA元素,所以F是氯元素。11.5g A单质恰好与100mL 5mol/L的盐酸完全反应,反应后溶液呈中性,因此A的相对原子质量是11.5÷0.5=23,所以A是钠元素,则B是Mg。D元素原子的最外层电子数比次外层电子数少4个,则D是硅。E元素原子的次外层电子数比最外层电子数多3个,则E是P。
