(12分)①~⑩是元素周期表中的十种元素:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(1)某同学对下列性质进行了对比,其中正确的是 。
A.原子半径:⑩>⑨>⑦
B.离子半径:⑨>④>⑦
C.非金属性:③>②>⑥
D.单质的熔点:④>⑨>⑩>⑧
E.单质的氧化性:③>⑦>⑧
(2)用合适的化学用语回答:
金属性最强的元素离子结构示意图为 ,
常温下呈液态的氢化物的结构式为: 。
溶于水后溶液显碱性的氢化物的电子式为: 。
(3)在上述元素中,②、⑧元素形成的气态氢化物可以相互反应,该反应的化学方程式为
;⑨、⑤元素形成的最高价氧化物的水化物可以相互反应,该反应的离子方程式为 。
(每空2分,共12分)
(1)CD。(2)示意图为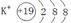 ,结构式为:H-O-H。电子式为:
,结构式为:H-O-H。电子式为: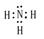
(3)化学方程式为NH3+HCl==NH4Cl;离子方程式为 Al(OH)3+OH-==AlO2-+2H2O
考查元素周期表的结构及元素周期律的应用,根据元素在周期表中的位置可知①~⑩分别是C、N、O、Na、Al、Si、S、Cl、K、Br。
(1)同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强;同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。所以原子半径是⑨>⑩>⑦,A不正确。同主族自上而下离子半径也是逐渐增大的,而核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以离子半径是⑦>⑨>④,B不正确。CD都是正确的。E不正确,应该是③>⑧>⑦。
(2)金属性最强的是钾元素,其离子的结构示意图为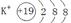 ;常温下呈液态的氢化物水,其结构式为H-O-H;溶于水后溶液显碱性的氢化物是氨气,电子式为
;常温下呈液态的氢化物水,其结构式为H-O-H;溶于水后溶液显碱性的氢化物是氨气,电子式为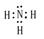 。
。
(3)②、⑧元素形成的气态氢化物分别是氨气和氯化氢,反应的方程式为NH3+HCl==NH4Cl。⑨、⑤元素形成的最高价氧化物的水化物氢氧化钾和氢氧化铝,反应的方程式为Al(OH)3+OH-==AlO2-+2H2O。
