下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
| 族
| IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ⑧ | |||
 (2)②⑦⑨的最高价含氧酸的酸性由强到弱的顺序为________________________。
(2)②⑦⑨的最高价含氧酸的酸性由强到弱的顺序为________________________。
 (3)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其中两种化合物的电子式: ___、 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的化合物,写出其中两种化合物的电子式: ___、 。
 (4)元素④的一种氢化物A在一定条件下分解为它的另一种氢化物B,写出A的结构式_______
(4)元素④的一种氢化物A在一定条件下分解为它的另一种氢化物B,写出A的结构式_______ 。
。
(5)由①④⑤⑨四种元素组成的两种化合物之间可以发生反应,写出离子方程式 。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
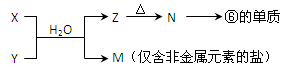
 X溶液与Y溶液反应的离子方程式为_____________________
X溶液与Y溶液反应的离子方程式为_____________________
 N→⑥的单质的化学方程式为_____________ _
N→⑥的单质的化学方程式为_____________ _
(1)Na>Al>O (2)H2SO4>H2CO3>H2SiO3
(3)  、
、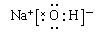 。 (4)H-O-O-H
。 (4)H-O-O-H
(5)HSO3-+H+=SO2↑+H2O (6)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2Al2O3 Al+3O2↑
Al+3O2↑
考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,①~⑨分别是H、C、N、O、Na、Al、Si、S、Cl。
(1)同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强;同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。所以④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,所以②⑦⑨的最高价含氧酸的酸性由强到弱的顺序为H2SO4>H2CO3>H2SiO3。
(3)H、O、Na形成既含离子键又含共价键的化合物是过氧化钠和氢氧化钠,电子式分别是 、
、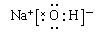 。
。
(4)双氧水在一定条件下能分解生成水和氧气,其结构式为H-O-O-H。
(5)由①④⑤⑨四种元素组成的两种化合物之间可以发生反应,这两种化合物是硫酸氢钠个亚硫酸氢钠,离子方程式为HSO3-+H+=SO2↑+H2O。
(6)要得到单质铝,需要通过电解熔融的氧化铝,所以N是氧化铝,则Z是氢氧化铝。所以X和Y是铝盐和氨水反应,生成氢氧化铝沉淀和铵盐。
