(8分)前四周期元素X、Y、Z、W核电荷数依次增加,并且X、Y、Z的核电荷数之和为32;Y原子基态时被电子占据的轨道有9个,其中6个被电子占满;非金属元素Z的 M层上成对电子与未成对电子所占据的原子轨道数相等;W3+离子的3d轨道中有10个电子。
(1)W基态原子的电子排布式为_____________
(2)Y可与X形成只含一个中心原子的共价化合物a,其电子式是__________;中心原子的价层电子对数为_______;a分子的立体构型是____________
(3)Z的低价氧化物既氧化性又有还原性,请分别举例说明____ _、_______(写化学方程式)。
(4)Y4分子的键角是 。我们还学过了很多与Y4空间构型相同但键角不同的分子,请列举一种分子 (写电子式)
(1) 1s22s22p63s23p63d104s24p1 (或[Ar]3d104s24p1 ) (2)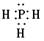 4 三角锥型
4 三角锥型
(3)2H2S+SO2=3S+2H2O SO2与O2、卤水等均可(合理即给分)
(4)60. 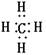 等(合理即给分)
等(合理即给分)
Y原子基态时被电子占据的轨道有9个,其中6个被电子占满则Y是P。非金属元素Z的 M层上成对电子与未成对电子所占据的原子轨道数相等,所以Z是S,因此X是H。W3+离子的3d轨道中有10个电子,是由W是Ga。
(1)根据构造原理可知,W基态原子的电子排布式为1s22s22p63s23p63d104s24p1 (或[Ar]3d104s24p1 )。
(2)Y可与X形成只含一个中心原子的共价化合物a是PH3,电子式为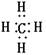 。由于磷原子还有1对孤对电子,所以中心原子的价层电子对数为4,因此空间构型是三角锥形。
。由于磷原子还有1对孤对电子,所以中心原子的价层电子对数为4,因此空间构型是三角锥形。
(3)SO2中硫元素的化合价处于中间价态,既有氧化性,还有还原性,有关反应式为2H2S+SO2=3S+2H2O、SO2+Cl2+2H2O=H2SO4+2HCl。
(4)白磷是正四面体型结构,其中键角是60°。与Y4空间构型相同但键角不同的分子是甲烷,键角是109°28ˊ。
