(本小题满分14分)a、b、c、d、e四种短周期元素的原子序数逐渐增大。a为非金属元素,且a、e同主族,c、d为同周期的相邻元素。e原子的质子数等于c、d原子最外层电子数之和。b原子最外层电子数是内层电子数的2倍。c的氢化物分子中有3个共价键。试推断:
(1)写出b元素在周期表中的位置 ;
(2)有a、c、d所形成的离子化合物是 它与e的最高价氧化物对应水化物的溶液加热时反应的离子方程式是 ;
(3)c的单质的电子式为 。
(4)b和d相比,非金属性较强的是 (用元素符号表示),下列事实能证明这一结论的是 (选填字母序号)。
A.常温下,b的单质呈固态,d的单质呈气态
B.d的氢化物的稳定性强于b的氢化物
C.b与d形成的化合物中,b呈正价
D.d的氢化物的沸点高于b的氢化物(5)元素b形成的一种单质具有硬度大、熔点高的物理性质,据此判断该单质的晶体类型为 。
(14分,每空各2分) (1)第二周期ⅣA族
(2)NH4NO3 NH4+ + OH-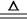 NH3 ↑+ H2O
NH3 ↑+ H2O
(3) (4)O (4) BC (5)原子晶体
(4)O (4) BC (5)原子晶体
根据元素的位置及结构特点可判断,a、b、c、d、e四种短周期元H、C、N、O、Na。
(1)碳元素位于周期表的第二周期第ⅣA。
(2)a、c、d所形成的离子化合物是硝酸铵,和氢氧化钠反应生成氨气,方程式为NH4+ + OH-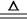 NH3 ↑+ H2O。
NH3 ↑+ H2O。
(3)澄清分子中含有三键,电子式为 。
。
(4)同周期自左向右非金属性逐渐减弱,所以氧元素的大于碳的。比较元素非金属性强弱的依据:1.依据非金属单质与H2反应的难易程度、剧烈程度和生成气态氢化物的稳定性。与氢气反应越容易、越剧烈,气态氢化物越稳定,其非金属性越强。
2.依据最高价氧化物的水化物酸性的强弱。酸性越强,其元素的非金属性越强。
3.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,非金属性逐渐增强;同主族中,由上而下,随着核电荷数的增加,非金属性逐渐减弱。
4.非金属单质与盐溶液中简单阴离子之间的置换反应。非金属性强的置换非金属性弱的。
5.非金属单质与具有可变价金属的反应。能生成高价金属化合物的,其非金属性强。
所以答案选BC。
(5)根据其物理性质可知,应该是原子晶体。
