某学生为了测定实验室中一瓶因保存不善而部分变质的氧氧化钠中碳酸钠的质量分数,设计了如下图所示的装置(图中铁架台已略去).实验是在27℃、110kPa下进行的,实验步骤如下:
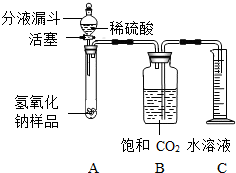
步骤1:按图连接好装置;
步骤2:用天平准确称取氢氧化钠样品2g,放A中试管内,向B中集气瓶内倒入饱和二氧碳水溶液到瓶颈处;
步骤3:向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,通过测量量筒中收集到饱和二氧化碳水溶液的体积, * * 生气体220mL.
(1)判断氢氧化钠发生变质的实验现象是______;氢氧化钠变质的原因是______;因此实验室中氢氧化钠必须______保存.
(2)在实验步骤1与步骤2之间,缺少一实验步骤,该实验步骤是______.
(3)B中集气瓶盛装饱和二氧化碳的水溶液不能用水代替,其理由是______.
(4)判断实验步骤3中滴入的稀硫酸已过量的标志是______.
(5)氢氧化钠样品中碳酸钠质量分数为______(此时二氧化碳的密度 为1.8g/L) (写出计算过程)
(6)用上述装置不能测定已部分变质的氢氧化钠样品中氢氧化钠的质量分数,其理由是______.
(1)氢氧化钠在空气中易吸收空气中的水分而潮解,然后会与空气中的二氧化碳反应而变质,所以氢氧化钠若变质,则会生成碳酸钠,那么当滴入稀硫酸时会产生二氧化碳气体,所以A中会冒出气泡,故本题答案为:A中有气泡产生(B中收集到气体/C中收集到液体) 与空气中的CO2反应 密封
(2)该实验过程中有气体参与,所以实验前必须检查装置的气密性,故本题答案为:检查装置气密性
(3)反应过程中要生成二氧化碳,而二氧化碳会和水反应或是溶于水,所以如果用水会导致实验结果的偏差,故本题答案为:二氧化碳能溶于水
(4)若氢氧化钠变质,当加入稀硫酸时则会生成气体,当不再产生气体时就说明反应完毕,故本题答案为:滴入稀硫酸,A中不再有气泡产生
(5)47.7%
CO2的质量:m(CO2)=220mL÷1000×1.8g/L=0.396g
设样品中碳酸钠质量为x
Na2CO3 +2HCl═2NaCl+H2O+CO2↑
106 44
X 0.396g
= 106 x
,解得:X=0.954g44 0.396g
样品中碳酸钠的质量分数为:
×100%=47.7%0.954g 2g
(6)氢氧化钠在空气中易吸收空气中的水分而潮解,然后才会与空气中的二氧化碳反应而变质,由于没有测算出水的质量,故现有的条件下难以测出氢氧化钠的质量分数,故本题答案为:氢氧化钠样品中除了碳酸钠,还有水
