(16分)下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下列问题:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
写出它与原子半径最小的原子形成六核且为平面结构的化合物的电子式_____。
(2)④⑤⑧形成的简单离子半径由大到小的顺序为_______________(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_____________________。(填化学式)
(3)工业上用②单质大量生产⑦单质,反应的化学方程式为:________________________________
⑦形成氧化物的晶体类型为__________,它的一种重要用途为 。
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是___________(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式_________________________________。
(5)X、Y由①②④中的两种或三种元素组成。X的溶液能与小苏打反应产生Y,若X是其所属系列中最简单的分子,且相对分子质量为46,则X的名称为 ,写出X溶液与小苏打反应的化学方程式为____________。
(共16分)(1)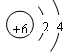 (1分)
(1分)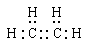 (1分)
(1分)
(2)S2->O2->Na +(2分) HClO4>HNO3>H2SiO3 (2分)
(3)SiO2 +2C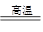 Si+ 2CO↑(2分)原子晶体 光导纤维(各1分)
Si+ 2CO↑(2分)原子晶体 光导纤维(各1分)
(4)Al2O3(1分) Al2O3 + 2 OH- =" 2" AlO2- + H2O(2分)
(5)甲酸 (1分) HCOOH + NaHCO3 = HCOONa + CO2↑ + H2O(2分)
考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知元素①~
⑨分别是H、C、N、O、Na、Al、Si、S、Cl。
(1)形成化合物种类最多的是碳元素,其原子结构示意图为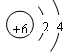 。原子半径最小的是
。原子半径最小的是
氢元素,所以该化合物是乙烯,电子式为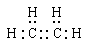 。
。
(2)同主族自上而下离子半径是逐渐增大的,而核外电子排布相同的微粒,其微粒半径随原子
序数的增大而减小,所以顺序是S2->O2->Na +。非金属性越强,最高价氧化物的水化物的酸性越
强,所以应该是HClO4>HNO3>H2SiO3。
(3)高温下碳还原二氧化硅即得到单质硅,反应式为SiO2 +2C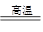 Si+ 2CO↑。二氧化硅是一
Si+ 2CO↑。二氧化硅是一
种原子晶体,常用作光导纤维。
(4)符合条件的应是两性氧化物氧化铝,和强碱反应的方程式为Al2O3 + 2 OH- =" 2" AlO2- +
H2O。
(5)和碳酸氢钠反应生成CO2,说明显酸性,根据相对分子质量可知,化合物是甲酸,反应式
为HCOOH + NaHCO3 = HCOONa + CO2↑ + H2O。
