在活动与探究实验中,老师提供了一包钾肥(包装上注明主要原因成份是硫酸钾,化学式为K2SO4,纯度为95.0%)样品给同学们,让同学们通过实验确定该样品的纯度(硫酸钾的质量分数)是否符合标准.丽丽同学称取8.0克样品,加入适量的水溶解后,与足量的BaCl2溶液充分反应,生成BaSO4沉淀,过滤、洗涤、烘干沉淀,测得其质量为9.8克,试通过计算确定该化肥的纯度是否符合包装袋上的说明(假设杂质不与BaCl2溶液反应,计算结果精确到0.1%).

设8.0克样品中所含K2SO4的质量为x.
K2SO4+BaCl2═BaSO4↓+2KCl
174 233
x 9.8g
=174 x 233 9.8g
解得x═7.32g
样品中所含K2SO4的质量分数=
×100%=92.0%7.32g 8.0g
因为92.0%<95.0%,该化肥的纯度不符合包装袋上的说明
答:该化肥的纯度不符合包装袋上的说明.

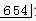 全金属冠桥蜡型后,将蜡型从工作模上取下,固定在成形座上,直接将铸圈放好,固定,2h后先倒包埋料后倒液,真空搅拌后,用毛笔将蜡型内外涂上一层,再把整铸圈注满。
全金属冠桥蜡型后,将蜡型从工作模上取下,固定在成形座上,直接将铸圈放好,固定,2h后先倒包埋料后倒液,真空搅拌后,用毛笔将蜡型内外涂上一层,再把整铸圈注满。