(9分)下图是中学教材中元素周期表的一部分,其中标出A~Q14种元素,试回答下列问题:
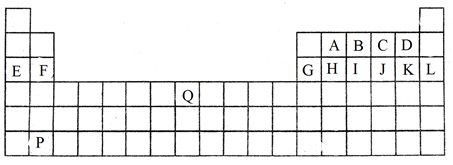
(1)在上表所列出的短周期元素中(填具体物质化学式)原子半径最小的是(除稀有气体元素) ;阴离子还原性最弱的是 ;
最高价氧化物对应的水化物中酸性最强的是 。
(2)F和G两元素相比较,金属性较强的是 (填名称),可以验证该结论的实验是 。(填编号)
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
(3)Q在元素周期表中的位置是 ,B元素形成的单质的结构式为 。
(4)写出E的最高价氧化物对应的水化物与G单质发生的反应的离子方程式:
。
(1)F;F-;HClO4(每空1分) (2)镁;bc(每空1分)
(3)第四周期 Ⅷ族;N≡N(每空1分) (4)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
考查元素周期表的结构及元素周期律的应用。
(1)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大。所以原子半径最小的是F。非金属性越强,相应阴离子的还原性越弱。氟的非金属性最强,所以氟离子的还原性最弱。非金属性越强,最高价氧化物的水化物的酸性越强,因此是HClO4。
(2)F和Q分别是镁和铁,根据金属活动顺序表可知,镁的金属性强于铁的。比较元素金属性强弱的依据是
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数例外)。
6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。
7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。所以据此可判断选项bc正确。
(3)根据铁的位置可知,铁位于第四周期第Ⅷ。用1根短线表示1对电子的式子是结构式,所以氮气的结构式为N≡N。
(4)金属铝能溶于氢氧化钠溶液中生成偏铝酸钠和氢气,方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑。