实验室中存放的氢氧化钠固体常常会混有少量的碳酸钠,小蓝就此问题展开了探究.
【资料收集】
(1)氢氧化钠可以与空气中的______反应,生成碳酸钠.碳酸钠水溶液显碱性,可使无色酚酞溶液变红.
(2)在常温、101kPa下CO2的密度为1.8g/L.
【实验方案1】目的:检验NaOH样品中是否混有Na2CO3.
小蓝设计了三个实验方案.请你对她的实验方案和结论作一个恰当的评价(即说明方案可行或不可行,并说明原因):
| 实验方案 | 对实验方案的评价 | |
| 方案1 | 将少量样品溶于蒸馏水后,滴入少许酚酞溶液,根据酚酞溶液是否变红,判断是否含有碳酸钠 | |
| 方案2 | 将少量样品溶于蒸馏水后,滴入少许稀盐酸溶液,根据是否产生气泡,判断是否含有碳酸钠 | |
| 方案3 | 将少量样品溶于蒸馏水后,滴入少许氯化钡溶液,根据是否产生白色沉淀,判断是否含有碳酸钠 |
小蓝的实验步骤如下(装置和药品如图所示):
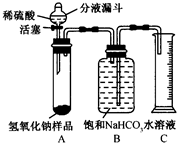
打开分液漏斗活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和NaHCO3溶液220mL.请你对小蓝的实验进行总结:
(1)已知B中集气瓶盛装的饱和NaHCO3溶液不能用水代替,试推测其理由是______.
(2)样品中含有的碳酸钠的质量为______g.
(3)为达到实验目的,本实验还缺少的一步实验操作是______.
(4)该实验中出现了以下问题,其中对测定NaOH样品中Na2CO3的质量分数有影响的是(填序号)______.
①称量前,氢氧化钠固体在空气中发生潮解
②装置A中加入的稀硫酸本身也占有一定的体积
③氢氧化钠样品中除了碳酸钠杂质以外,还含有少量氯化钠.
(1)氢氧化钠与空气中的二氧化碳反应,生成碳酸钠和水.
【实验方案1】方案1,因为氢氧化钠溶液和碳酸钠溶液都显碱性,都能使酚酞试液变红,因此该方案不可行.
方案2:氢氧化钠量很大,会与少量的盐酸先发生反应,因而即使有碳酸钠存在,由于盐酸与氢氧化钠反应完了,也可能看不到气泡.该方案不可行.
方案3:氢氧化钠不能与氯化钡发生反应,而碳酸钠可以与氯化钡反应生成沉淀,所以该方案可行.
【实验方案2】(1)小蓝的实验设计是利用稀硫酸与碳酸钠反应生成二氧化碳将碳酸氢钠溶液排到量筒中,量筒中液体的体积等于生成的二氧化碳的体积.由于二氧化碳能溶于水,难溶于碳酸氢钠溶液,所以不能用水代替碳酸氢钠溶液.
(2)设碳酸钠的质量为x
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 0.22L×1.8g/L
=106 x 44 0.22L×1.8g/L
x=0.954g
(3)要测定样品中碳酸钠的质量分数,需用碳酸钠的质量除以样品的总质量,因此还缺少的一步操作是测定所取样品的质量.
(4)①称量前,氢氧化钠固体在空气中发生潮解,总样品质量变大,不影响碳酸钠的质量,而碳酸钠的质量分数变小,故有影响.
②装置A中加入的稀硫酸本身也占有一定的体积,使排出的碳酸氢钠溶液的体积增多,从而使碳酸钠质量增大,测定结果偏高.
③氢氧化钠样品中除了碳酸钠杂质以外,还含有少量氯化钠.不影响碳酸钠的质量,故没有影响.
故选①②
故答案为:
【资料收集】(1)二氧化碳
【实验方案1】
方案1 不可行,氢氧化钠也可使无色酚酞溶液变红,会干扰检验
方案2 不可行,氢氧化钠量很大,会与盐酸先发生反应,因而即使有碳酸钠存在也可能看不到气泡
方案3 可行,氢氧化钠不能与氯化钡发生反应,而碳酸钠可以与氯化钡反应生成沉淀
【实验方案2】
(1)二氧化碳可溶于水,难溶于饱和NaHCO3溶液(或二氧化碳在饱和NaHCO3溶液中的溶解度很小),这样可以避免因二氧化碳溶于水造成的测量误差 (2)0.954 (3)测定所取样品的质量 (4)①②
