(12分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序为___________________。
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是____________。
 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
 (4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
 X溶液与Y溶液反应的离子方程式为_____________________,
X溶液与Y溶液反应的离子方程式为_____________________,
 N→⑥的单质的化学方程式为________________。
N→⑥的单质的化学方程式为________________。
(1)Na>Al>O (2)HNO3>H2CO3>H2SiO3 (2)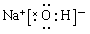 (4)a b
(4)a b
(5)Al3++3NH3·H2O2=Al(OH)3↓+3NH4+、2Al2O3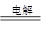 4Al+3O2↑
4Al+3O2↑
(1)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,所以大小顺序为Na>Al>O。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,非金属性是N>C>Si,所以酸性顺序是)HNO3>H2CO3>H2SiO3 。
(3)①、④、⑤、⑧分别是H、O、Na、Cl,所以既含离子键又含极性共价键的化合物是氢氧化钠或次氯酸钠,电子式分别是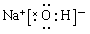 、
、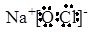 。
。
(4)1:1组成的常见液态化合物是双氧水,催化剂是a和b。
