(8分)A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
(2)①在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和相应的固态化合物时,放出a KJ热量,此反应的热化学方程式是
②A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是
(3)向2mL 0.5mol/L的ACl3溶液中加入3mL 3mol/L KF溶液,ACl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是(已知氧化性Fe3+>I2)
(填字母)。
a. A3+不与I-发生反应 b. A3+与F-结合生成不与I-反应的物质
c. F-使I-的氧化性减弱 d. A3+被F-还原为A2+,使溶液中不再存在A3+
(1)2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
(2)①3Fe(s)+4H2O(g)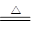 Fe3O4(s)+4H2(g) △H=-akJ/mol(2分)
Fe3O4(s)+4H2(g) △H=-akJ/mol(2分)
②2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(2分) (3)b (1分)
根据元素的结构及性质可知,A是Fe,B是Cu,C是Al,D是O,E是H。
(1)铝能和氢氧化钠溶液反应生成偏铝酸钠和氢气,方程式为
2Al+2OH-+2H2O=2AlO2-+3H2↑。
(2)①D、E组成的气态化合物是水,生成8gE的单质放出a KJ热量,所以热化学方程式为3Fe(s)+4H2O(g)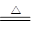 Fe3O4(s)+4H2(g) △H=-akJ/mol。
Fe3O4(s)+4H2(g) △H=-akJ/mol。
②氯化铁具有氧化性,能把SO2氧化生成硫酸,方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
(3)加入KI溶液和CCl4振荡后静置,CCl4层不显色,说明没有单质碘生成,及铁离子和F-结合生成了不与I-反应的物质,所以答案选b。
