某学生为测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在
27℃,l01kPa下进行,实验步骤如下:
①按图连接好装置;
②______;
③用天平准确称取氢氧化钠样品6g,放入A中试管内,向B中集气瓶内装满饱和二氧化碳水溶液;
④向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和二氧化碳水溶液220mL.
请回答下列问题:
(1)在实验步骤①~③之间,还缺少一个步骤,请将其补充在②后面的横线上.
(2)判断氢氧化钠发生变质的实验现象是______,氢氧化钠变质的原因是______ (用化学方程式表示).
(3)B中集气瓶盛装的是饱和二氧化碳水溶液而不是水,其理由是______.
(4)判断步骤④中滴人的稀硫酸已过量的标志是______.
(5)氢氧化钠样品中碳酸钠的质量分数为______(27℃,l01kPa下二氧化碳的密度为l.8g/L,二氧化碳的体积等于排出的饱和二氧化碳水溶液的体积).
(6)要除去部分变质氢氧化钠中的碳酸钠,应将这种氢氧化钠样品溶于水配成溶液,然后向溶液中加适量的______,充分反应后过滤、蒸干滤液,就能得到比较纯净的氢氧化钠固体.反应方程式为______.
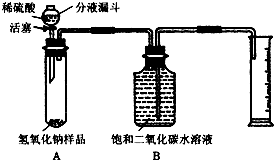
(1)该装置要求气密性良好,才能准确测量出二氧化碳的体积,所以实验前应先检查装置的气密性.
(2)氢氧化钠是碱,可以和空气中的二氧化碳反应,生成碳酸钠而变质,若变质生成的碳酸钠与稀硫酸会生成二氧化碳气体.
(3)本题的实验目的是通过测二氧化碳的体积来计算药品中碳酸钠的含量,所以必须保证二氧化碳的准确性,因为二氧化碳可以溶于水,所以用饱和的二氧化碳水溶液,可以避免二氧化碳的减少.
(4)证明硫酸过量,即证明碳酸钠反应完,所以可以继续滴一滴硫酸,没有气泡产生.
(5)生成二氧化碳的质量为:
L×1.8 g/L=0.396 g220 1000
设样品中含碳酸钠的质量为x
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
106 44
x 0.396g
=106 x
,44 0.396g
解之得:x=0.954g
∴样品中碳酸钠的质量分数=
×100%=15.9%0.954g 6g
(6)氢氧化钠溶液变质后就是碳酸钠,氢氧化钙可以和碳酸钠发生反应,生成碳酸钙沉淀.故要除掉部分变质的氢氧化钠溶液中的杂质,可以加入Ba(OH)2溶液,过滤出反应生成的BaCO3;
故答案为:(1)检查装置气密性
(2)向氢氧化钠样品中滴加稀硫酸时产生气泡 2NaOH+CO2═Na2CO3+H2O
(3)CO2能溶于水,而不溶于饱和的CO2水溶液中
(4)装置A中试管内没有气泡产生
(5)15.9%
(6)Ba(OH)2或Ca(OH)2 Ba(OH)2+Na2CO3═BaCO3↓+2NaOH或Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
