(16分)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
(1)请写出字母O代表的元素符号 ,该元素在周期表中的位置 。
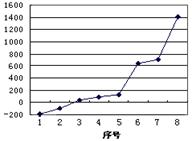
(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号)。
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释: 。
(4)k与l形成的化合物kl2的电子式是 ,它在常温下呈液态,形成晶体时,属于
晶体。
(5)i单质晶体中原子的堆积方式如下图(甲)所示,其晶胞特征如下图(乙)所示,原子之间相互位置关系的平面图如下图(丙)所示。
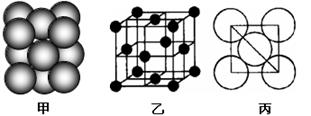
若已知i的原子半径为d,NA代表阿伏加德罗常数,i的相对原子质量为M,请回答:
晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 , 该晶体的密度为__________________(用M、NA、d表示)。
(1)Fe (1分) 第四周期第VIII族 (1分)
(2) Si (1分) ; 2 (1分)
(3)SiC (1分);因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小, SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高 (2分)。
(4)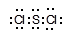 (2分) ;分子 (1分)
(2分) ;分子 (1分)
(5)12 (2分);4 (2分);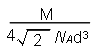 或
或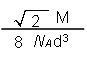 (2分)
(2分)
(1)根据O的物质可知,应该是铁元素,位于周期表中第四周期第VIII族。
(2)由于单质硅形成的晶体是原子晶体,所以熔点最高的是硅。非金属性越强,电负性越大,所以应该是氯元素。氯气的熔点仅比Ar的高,所以是2号。
(3)c和j分别是碳和硅,SiC和单质硅形成的都是原子晶体。由于碳原子半径小于硅原子半径,所以碳硅键要强于硅和硅之间形成的共价键,因此熔沸点高于硅单质的。
(4)k与l分别是S和Cl,二者形成的化学键是极性键,所形成的晶体在常温下呈液态,所以是分子晶体,其电子式为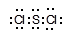 。
。
(5)i是铝,根据甲图可知,和铝原子距离最近的原子共有3×8÷2=12个。根据乙图可知,一个晶胞中铝原子的数目为8×1/8+6×1/2=4。根据丙图可知,晶胞的边长是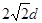 ,所以有
,所以有 ,解得ρ=
,解得ρ=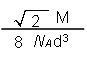 。
。

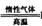 Li2FeSiO4 +Li2SO4 +SiO2
Li2FeSiO4 +Li2SO4 +SiO2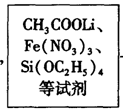
 Li2FeSiO4
Li2FeSiO4 Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;
Li2FeSiO4则该电池的负极是____ ;充电时,阳极反应的电极反应式为 ;