(12分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为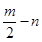 。请回答下列问题:
。请回答下列问题:
(1)D元素在周期表中的位置是_____________________;
(2)写出一个E和D形成的化合物与水反应的离子方程式_______________________;
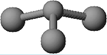
(3)已知:甲 + H2O → 丙 + 丁。若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的化学式为 。
(4)与D同主族上下相邻的元素M、N,原子电子层数M>N>D,三种元素氢化物沸点由大到小的顺序是(填写化学式) 。
(5)写出B与D在高温下完全反应后生成物的电子式___ __ ,结构式___
(1) 第二周期VIA族(2分)
(2)Na2O+H2O=2Na++2OH‒或2Na2O2+2H2O=4Na++4OH‒+O2↑ (2分)
(3)+1(1分),NH3(1分)
(4)H2O>H2Se>H2S(2分)(5) (2分),O=C=O(2分)
(2分),O=C=O(2分)
根据元素的结构及核外电子的排布规律可知,A、B、C、D、E五种短周期元素分别是H、C、N、O、Na。
(1)氧元素位于第二周期VIA族。
(2)钠和氧形成的氧化物是氧化钠或过氧化钠,和水反应的离子方程式为Na2O+H2O=2Na++2OH‒或2Na2O2+2H2O=4Na++4OH‒+O2↑。
(3)根据分子的结构模型可知,甲是NCl3,结构类似于氨气的,所以氯元素的化合价是+1价。丙具有漂白性,则丙是次氯酸,又因为丁与H2O有相同的电子总数,则丁应该是是氨气。
(4)由于水分子间存在氢键,所以水的沸点在同主族元素的氢化物中沸点最高,因此答案是H2O>H2Se>H2S。
(5)碳和氧在高温下反应生成的氧化物是CO2,含有极性键,电子式为 。用1根短线代替电子对的式子是结构式,所以CO2的结构式为O=C=O。
。用1根短线代替电子对的式子是结构式,所以CO2的结构式为O=C=O。

 ,
,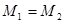 ,则一定
,则一定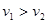
 ,
,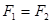 ,
,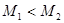 ,则一定
,则一定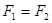 ,
, ,则一定
,则一定