(11分)已知A、B、C、D、E五种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的元素在元素周期表中的位置是 ;
(2)B和C的分子式分别是_______和_______,C分子的立体构型呈_____形,属于_______分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成,则D的结构式是________,该反应的化学方程式为__________________;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2mol H2O,则E是 (填名称)。E可以作为燃料电池的燃料,请写出以E为燃料,O2做氧化剂,KOH为电解质溶液组成的燃料电池的负极反应方程式 。
(11分)(1)第三周期0族 (2)HCl H2S V 极性
(3)H-O-O-H 2 H2O2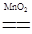 2H2O+O2↑
2H2O+O2↑
(4)甲醇;CH3OH-6e- +8OH¯=CO32- + 6H2O
(1)A是含有18个电子的单原子分子,因此是Ar,位于第三周期0族。
(2)B、C都是两种元素原子形成18电子分子,而B、C中分别含有2和3个原子,所以B是氯化氢,C是硫化氢。硫化氢中硫原子含有(6-1×2)÷2=2对孤对电子,所以是V型结构,属于极性分子。
(3)向D的稀溶液中加入少量二氧化锰,有无色气体生成,因此D是H2O2,其结构式为H-O-O-H,反应的方程式为2 H2O2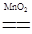 2H2O+O2↑。
2H2O+O2↑。
(4)根据E的燃烧产物可知,E中含有1个碳原子和4个氢原子,所以要满足18电子,则还需要1个氧原子,所以E是甲醇。原电池中负极失去电子,所以甲醇在负极通入。又因为溶液显碱性,所以负极反应式为CH3OH-6e- +8OH¯=CO32- + 6H2O。
