(12分)①~⑧是元素周期表中的部分元素。
 族 族周期 | IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素③④⑧的气态氢化物中最稳定的是__________(填化学式)。
(2)元素⑤和⑦的最高价氧化物对应水化物反应的离子方程式是__________。
(3)元素⑥和⑧形成的化合物的电子式是__________。
(4)某同学为了比较元素②和硅元素非金属性的相对强弱,用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。请回答:
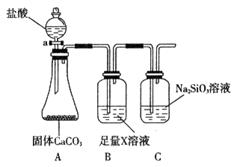
a. X是__________(填化学式),B装置的作用是__________。
b. 能说明元素②和硅元素非金属性强弱的实验现象是__________,相关的化学方程式是__________。同主族元素从上到下__________,得电子能力逐渐减弱,非金属性逐渐减弱。
(5)请设计实验比较元素⑥与⑦金属性的相对强弱__________。
(1)HF(1分,写F不给分)
(2)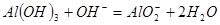 (2分,写化学方程式或没配平不给分)
(2分,写化学方程式或没配平不给分)
(3)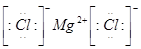 (1分) (4)a.
(1分) (4)a. 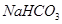 (1分)
(1分)
吸收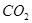 中混有的
中混有的 气体(1分) b. C中产生白色胶状沉淀(1分)
气体(1分) b. C中产生白色胶状沉淀(1分)
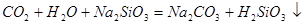 (2分,写
(2分,写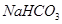 、离子方程式均给分)
、离子方程式均给分)
电子层数逐渐增加,原子半径逐渐增大(1分,任答一点即可)
(5)取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象。(2分,未注明酸浓度相同扣1分,其他合理答案,如与热水、原电池、最高价氧化物的水化物的碱性比较等酌情给分,但答成原理不给分)
考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,①~⑧分别是H、C、O、F、Na、Mg、Al、Cl。
(1)非金属性越强相应氢化物的稳定性越强,所以应该是HF。
(2)氢氧化铝是两性氢氧化物,能溶于氢氧化钠中,方程式为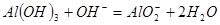 。
。
(3)镁和氯都是活泼的金属和非金属,二者形成的化学键是离子键,电子式为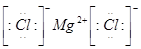
(4)A装置是产生CO2的,但由于生成CO2分子中含有氯化氢,而氯化氢也能和硅酸钠反应,所以需要除去CO2中的氯化氢,因此X是碳酸氢钠,原来吸收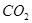 中混有的
中混有的 气体;同主族元素从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。因此C的非金属性强于硅的,则CO2就能制取硅酸,所以实验现象就是C中产生白色胶状沉淀,方程式为
气体;同主族元素从上到下电子层数逐渐增加,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱。因此C的非金属性强于硅的,则CO2就能制取硅酸,所以实验现象就是C中产生白色胶状沉淀,方程式为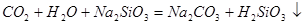 。
。
(5)考查金属性强弱比较。比较元素金属性强弱的依据可以是
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
即取一小段镁条和一小片铝片,磨去表面氧化膜,分别放入2支试管中,各加入等体积等浓度的盐酸,观察发生的现象。
