在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞,这些分子称为活化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位用kJ·mol-1表示。请认真观察下图,然后回答问题。
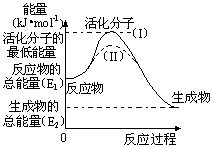
(1)图中反应是________(填“吸热”或“放热”)反应,该反应的△H=________(用含E1、E2的代数式表示)
(2)已知热化学方程式:H2(g)+1/2O2(g) === H2O(g) △H=-241.8kJ·mol-1,该反应的活化能为
167.2kJ·mol-1,则其逆反应的活化能为________。
(3)对于同一反应,图中虚线(II)与实线(I)相比,活化能大大降低,活化分子的百分数增多,反应速率加快,你认为最可能的原因是______________________。
(4)已知C(石墨 s)的燃烧热为393.5kJ/mol,C(金刚石 s)的燃烧热为395.0kJ/mol
①写出表示石墨燃烧热的热化学方程式:____________________________
②写出石墨转化成金刚石的热化学方程式:____________________________
③根据②有同学认为该反应很容易进行,但事实上该反应却很难发生,需要很高的温度和很高的压强,请你分析造成这种原因的主要因素是______________________________
(1)放热;E1-E2
(2)409.0 kJ/mol
(3)使用了催化剂
(4)①C(石墨 s)+O2(g)=CO2(g)△H=-393.5kJ/mol
②C(石墨 s)= C(金刚石 s)△H=+1.5 kJ/mol
③该反应的活化能很高,因此引发该反应需要很高的温度和很高的压强
