(8分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
(1)请写出元素O的基态原子电子排布式
。
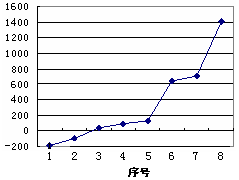
(2)第三周期8种元素按单质熔点高低的顺序如右图,其中序号“8”代表
(填元素符号);其中电负性最大的是 (填右图中的序号)。
(3)由j原子跟c原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释:
。
(1)1s22s22p63s23p63d64s2(2分) (2) Si; 2 (2分)
(3)SiC;(1分);因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高。(3分)
(1)根据元素的位置可判断,O是铁元素。因此根据构造原理可知,核外电子排布式为1s22s22p63s23p63d64s2。
(2)第三周期中,熔点最高的是原子晶体硅,即8号是Si。非金属性越强,电负性越大,所以。所以电负性最大的是Cl,Cl的熔点仅比Ar的高,所以应该是2号。
(3)两种元素分别是C和Si,形成的SiC是原子晶体。因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高。