有一瓶混有硫酸钠的碳酸钠样品.为测定其中所含碳酸钠的质量分数,甲、乙两同学各称量样品10g,分别溶解在足量的水中,用所得溶液和相同的试剂(A和B)做实验.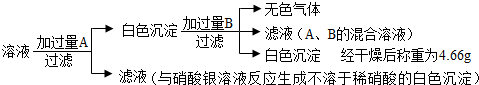
乙同学设计的方案,实验步骤更简单,实验过程如下: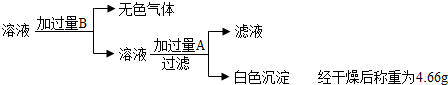
根据上述实验回答:
(1)在乙同学的实验方案中:
①最终所得滤液里的溶质是______;
②检验加入的A是否过量的方法是______.
(2)样品中碳酸钠的质量分数是______.
甲方案:硫酸钠与碳酸钠混合溶液中加入过量A产生白色沉淀和能与硝酸银反应产生氯化银沉淀的物质,因此过量的A为氯化钡溶液,白色沉淀为硫酸钡和碳酸钡,在沉淀中加入过量B产生气体,并且得到的滤液中只含氯化钡和B,因此加入的B为盐酸,盐酸和碳酸钡反应产生二氧化碳、氯化钡和水.
乙方案:溶液中加入过量盐酸,碳酸钠与盐酸反应产生二氧化碳、氯化钠和水,所得溶液中含有氯化钠、硫酸钠和过量的盐酸,再加过量A氯化钡溶液后,硫酸钠与氯化钡反应生成硫酸钡沉淀和氯化钠,因此最终所得滤液中含有氯化钠、过量的氯化钡和过量的盐酸
(1)由上述分析可知①最终所得滤液里的溶质是 NaCl、BaCl2、HCl
②检验加入的A氯化钡是否过量,根据钡离子与硫酸根离子能结合成硫酸钡沉淀,因此可取少量滤液滴加稀硫酸(或硫酸钠溶液等),如有白色沉淀生成,则说明加入的A过量.
(2)根据乙方案进行计算
设样品中硫酸钠的质量为x
Na2SO4+BaCl2═BaSO4↓+2NaCl
142 233
x 4.66g
=142 x 233 4.66g
x=2.84g
样品中碳酸钠的质量为10g-2.84g=7.16g
碳酸钠的质量分数=
×100%=71.6%7.16g 10g
故答案为:(1)①NaCl、BaCl2、HCl(写出物质名称同样得分)
②取少量滤液滴加稀硫酸(或硫酸钠溶液等),如有白色沉淀生成,则说明加入的A过量.
(2)71.6%
