(10)(1)可正确表示原子轨道的是: ① 。
A.2s B.2d C.3pz D.3f
(2)写出原子序数31的基态镓(Ga)原子的电子排布式: ② 。
(3)下列物质变化,只与范德华力有关的是 ③ 。
A.干冰熔化 B.乙酸汽化
C.乙醇与丙酮混溶 D.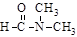 溶于水
溶于水
E.碘溶于四氯化碳 F.石英熔融
(4)下列物质中,只含有极性键的分子是 ④ ,既含离子键又含共价键的化合物是 ⑤ ,
只存在σ键的分子是 ⑥ ,同时存在σ键和π键的分子是 ⑦ 。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
(5)用“>” “< ” “=” 填空:
第一电离能的大小:Mg ⑧ Al;熔点的高低:KCl ⑨ MgO。
(1)①AC。 (2)②1s2 2s22p6 3s23p63d10 4s24p1。 (3)③AE。
(4)④BC。 ⑤G。 ⑥CE。 ⑦ABD。(2分)
(5)⑧>。 ⑨<。
(1)L层没有d轨道,选项B不正确;同样M层也没有f轨道,选项D不正确,因此正确的答案选AC。
(2)根据构造原理可知,原子序数31的基态镓(Ga)原子的电子排布式1s2 2s22p6 3s23p63d10 4s24p1。
(3)干冰熔化破坏的是分子间作用力;乙酸汽化破坏的是氢键;乙醇与丙酮互溶破坏的是氢键; 溶于水,肽键水解,破坏的是共价键;碘溶于四氯化碳破坏的是分子间作用力;石英熔融
溶于水,肽键水解,破坏的是共价键;碘溶于四氯化碳破坏的是分子间作用力;石英熔融
破坏的是共价键,因此正确的答案选AE;单键都是σ键,所以只存在σ键的分子是CE;
(4)不同的非金属元素间形成的共价键是极性键,因此只含有极性键的分子是BC;活泼的金属与活泼的非金属容易形成离子键,所以既含离子键又含共价键的化合物是G;双键和三键中既有σ键,也有π键,所以同时存在σ键和π键的分子是ABD。
(5)金属性越强,第一电离能越小。但也有镁中3s轨道电子处于全充满状态,稳定性强,所以第一电离能大于铝的;氧化镁中晶格能大于氯化钾的晶格能,所以熔点是氧化镁的高于氯化钾的。
