过碳酸钠(Na2CO4)和盐酸反应的化学方程式为2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中往往含有少量的碳酸钠,为了测定其纯度,现称取0.9g样品进行实验.供实验选用的仪器、试剂如图所示.
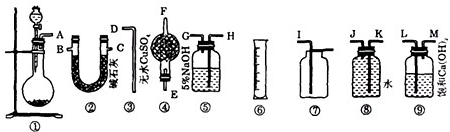
(1)为了使实验尽可能简单,应选用的装置是______(填编号①、②、…).
(2)所选用的装置的连接顺序是______(填字母,胶管已略去).
(3)为了能通过实验和计算求得样品的纯度.应通过排水量气装置测定出氧气的体积,若所测定的氧气的体积折算为质量表示,且为mg,则样品中Na2CO4的质量分数为______.
(1)过碳酸钠和盐酸反应为固体和液体反应且不需要加热,故选择装置①.要测定生成氧气的量,需要先除去二氧化碳,可用氢氧化钠溶液吸收二氧化碳,再通入水中,F量筒中水的体积即为E装置中氧气排开水的体积,二者体积相等.则为了使实验尽可能简单,应选用的装置是 ①⑤⑧③⑥;
(2)由(1)分析,可知:所选用的装置的连接顺序是 AHGJKD;
(3)依据测定的氧气体积计算物质的量,结合化学方程式计算过碳酸钠物质的量计算得到质量分数,样品质量0.9g,测定的氧气的体积折算为质量表示,且为mg,依据其化学方程式为:
设反应的过碳酸钠的质量为x.
2Na2CO4+2H2SO4═2Na2SO4+2CO2↑+O2↑+2H2O,
24432
x mg
则
=244 x
,解得x=32 mg
,故反应的过碳酸钠的质量61mg 8
,61mg 8
则该样品中Na2CO4的质量分数=
×100%=61mg 8 0.9g
×100%,305m 36
故答案为:
(1)①⑤⑧③⑥.(2)AHGJKD.(3)
×100%.305m 36
