(8分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | 能形成双原子气体分子,原子中有三个单电子 |
| X | 核外有5个能级,最高能级上只有1个电子 |
| Y | 最外层电子数是次外层电子数2倍 |
| Z | 最高正价为+7价 |
(2)X的硫酸盐与过量氢氧化钡反应的离子反应方程式为__________。
(3)COZ2俗称光气,其中碳氧原子之间的共价键有 个σ键, 个π键
(4)TH3的空间构型为 。 (填“难”或“易”)溶于CCl4。
(8分)(1)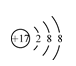 [Ar]3d6
[Ar]3d6
(2)2Al3++3SO42-+3Ba2++8OH-=2[Al(OH)4]-+3BaSO4 ↓
(3) 1 个σ键, 1 个π键 (4)三角锥形 难
根据元素的结构及有关性质可知,T是N,X是Al,Y是C,Z是Cl。
(1)氯离子核外电子数是18,所以氯离子结构示意图是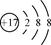 。地壳中含量仅次于Al的是铁,根据构造原理可知,该元素的+2价阳离子的电子排布式是[Ar]3d6。
。地壳中含量仅次于Al的是铁,根据构造原理可知,该元素的+2价阳离子的电子排布式是[Ar]3d6。
(2)由于氢氧化铝是两性氢氧化物,所以硫酸铝和过量的氢氧化钡反应的方程式是2Al3++3SO42-+3Ba2++8OH-=2[Al(OH)4]-+3BaSO4 ↓。
(3)在光气中碳氧之间形成的双键,而碳原子和氯原子之间形成的是单键。又因为双键是由1个σ键和1个π键构成的,而单键全部是由σ键构成的,所以碳氧原子之间的共价键有1个σ键和1个π键。
(4)氨气是三角锥形,属于极性分子,根据相似相溶原理可知,氨气难溶在非极性分子四氯化碳中。

