已知某食盐中掺有纯碱.为测定纯碱含量,按下图装置进行实验:实验步骤:
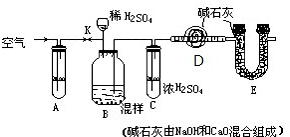
(1)组装仪器______.
(2)准称D装置为m1克.
(3)准称样品混合物的质量n克放也入B内.
(4)______,使稀H2SO4缓缓滴在样品上,直至不再产生气泡.
(5)向A中鼓入空气,要缓缓进气几分钟后,再称______(仪品名称)的总质量为m2克),
请你:(1)将步骤中缺处补充完整.
(2)鼓入空气目的是______,A应盛______溶液(俗称),用作______.
(3)步骤4、5操作要慢,缓其目的是______,过快,导致实验值______(偏大或小).
(4)E作用______.
(5)由记录数据处理,含有纯碱的质量分数为______.
(6)夹子K在______操作后打开.
(1)设计到有气体参加或气体生成的反应,装置的气密性必须良好;故填:检查气密性;
(4)B中产生的二氧化碳气体不能进入装置A,所以要夹上夹子K;故填:夹上夹子K;
(5)生成的二氧化碳气体会被碱石灰完全吸收,碱石灰增重的质量就是产生二氧化碳的质量.故填:D.
请你:(2)鼓入空气的目的是驱赶装置中的气体,使反应生成的二氧化碳气体被D中碱石灰完全吸收.故填:驱赶装置中的气体,使反应生成的二氧化碳气体被D中碱石灰完全吸收.
装置A能够除去空气中的二氧化碳,氢氧化钠溶液能够吸收二氧化碳.故填:烧碱;吸收空气中的二氧化碳.
(3)操作4、5要缓慢进行,是为了二氧化碳气体被碱石灰完全吸收,如果操作过快,部分二氧化碳没有被碱石灰吸收,导致实验测量值偏小;故填:使二氧化碳能够被碱石灰充分吸收;偏小.
(4)E装置的作用是防止空气中的二氧化碳与水蒸气被D中碱石灰吸收使测定结果偏大.故填:防止空气中的二氧化碳与水蒸气被D中碱石灰吸收使测定结果偏大.
(5)根据题意,生成二氧化碳的质量为:(m2-m1)g,
设纯碱样品中Na2CO3的质量为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
10644
x(m2-m1)g
106:44=x:(m2-m1)g
x=
g53(m2-m1) 22
纯碱样品中碳酸钠的质量分数为:
g÷ng×100%=53(m2-m1) 22
×100%.故填:53(m2-m1) 22n
×100%.53(m2-m1) 22n
(6)待B装置中不再产生气泡后再打开夹子K.故填:第(4).
