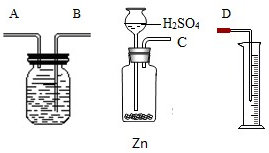
在实验室里用ωg含杂质的锌粒跟足量的稀H2S04反应(杂质不与稀H2S04反应),来测定该锌粒中单质锌的质量分数.所用实验装置如图所示.
(1)写出发生反应的化学方程式;
(2)按实验中气体的流向连接各接口(用接口字母表示);
(3)该实验中量筒的作用是什么;
(4)从实验装置和相关操作来看,要想求出原锌粒中单质锌的质量分数,还需要知道哪些物理量?(用字母表示)
(5)写出计算锌的质量分数的表达式(用各物理量字母表示,不必化简).
(1)锌和硫酸反应生成硫酸锌和氢气,发生反应的化学方程式Zn+H2SO4═ZnSO4+H2↑;
(2)氢气的密度小于水的密度,所以要将水从集气瓶内排出,需要气体从A管进,B管出,所以实验的链接顺序为C→A→B→D;
(3)量筒内水的体积等于氢气的体积,所以该实验中量筒的作用是量取生成的H2体积;
(4)量筒内水的体积等于氢气的体积,然后利用氢气的密度可以求出氢气的质量,从而求出参加反应的锌的质量,所以要想求出原锌粒中单质锌的质量分数,还需要知道氢气的密度;
(5)设参加反应的锌的质量为x.
Zn+H2SO4═ZnSO4+H2↑
65 2
x VH2•рH2
=65 x 2 VH2•рH2
x=65VH2•рH2 2
锌的质量分数=
×100%=65VH2•рH2 2 w
×100%.65VH2•рH2 2w
故答案为:(1)Zn+H2SO4═ZnSO4+H2↑;
(2)C→A→B→D;
(3)量取生成的H2体积;
(4)该条件下氢气的密度рH2;
(5)Zn%=
×100%.65VH2•рH2 2w
