(14分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
(2)c、d原子半径大小c d,第一电离能大小关系是c d,电负性大小关系是c d。(以上填“>”” “<”)
(3)已知NH3·H2O的电离方程式为NH3·H2O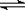 NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____ __ (填序号) 。
NH4++OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是____ __ (填序号) 。
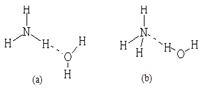
(4)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚面离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
①原子核对核外电子的吸引力 ②形成稳定结构的倾向
下表是一些主族元素的气态原子失去核外不同电子所需的能量(KJ·mol-):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
(14分)(1)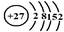 (2分) (2)>(2分) >(2分) <(2分)
(2分) (2)>(2分) >(2分) <(2分)
(3)b(2分) (4)Na(2分) Al(2分)
考查元素周期表的结构及元素周期律的应用。
(1)根据钴元素在周期表中的位置可知,钴元素的原子序数是27,所以该元素的原子结构示意图为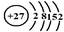 。
。
(2)c、d原子分别是N和O。由于同周期自左向右原子半径逐渐减小,所以碳原子半径大于氮原子半径。非金属性越强,第一电离能越大,氧元素的非金属性强于氮元素的,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,所以第一电离能是氮元素大于氧元素;非金属性越强,电负性越大,所以氧元素的电负性强于氮元素的。
(3)应用氮元素的非金属性强,能和水中的氢元素形成氢键,所以形成的NH3·H2O的合理结构是b,即答案选b。
(4)X原子失去第二个电子需要的能量远高于失去第一个电子需要的能量,又因为X的第一电离能小于LI的,因此X是第IA元素,所以X是Na 。Y原子失去第四个电子需要的能量远高于失去第三个电子需要的能量,因此Y是第ⅢA元素。又因为Y的第一电离能大于钠的第一电离能,所以Y是Al。
