(14分)已知元素周期表中共有18纵行,如图实线表示元素周期表的边界,按电子排布,可把周期表划分为s区、p区、d区、ds区等。除ds区外,其他区的名称均按构造原理最后填入电子的能级符号来命名。

(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并标记分区。
(2)有的同学受这种划分的启示,认为d区内6、7纵行的部分元素可以排在另
一区,你认为应排在________区。
(3)请在元素周期表中标出4s轨道半充满的元素(用元素符号表示)。
(4)随着科学技术的发展,不断有新的元素被发现。若把第七周期排满,则元
素周期表共可以排布________种元素。
(5)在周期表中,电负性最大的元素是 ,该元素的原子轨道图 。
写出该单质与水反应的化学方程式: 。
(共14分)
(1)(4分)
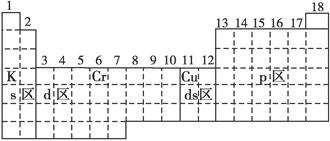
(2)ds(1分) (3)如上图所示(3分) (4) 118(1分)
(5)F 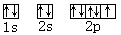 2F2+ 2H2O ="==" 4 HF + O2 5分
2F2+ 2H2O ="==" 4 HF + O2 5分
(1)区的名称来自于按照构造原理最后填入电子的能级的符号,所以s区、p区、d区、ds区中的位置分别是(如图所示)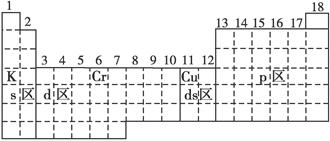
(2)由于d区内6、7纵行的部分元素最后填入电子的能级是s、d能级,所以这些元素可以化为ds区。
(3)根据构造原理可知,在元素周期表中4s轨道半充满的元素是Cr或Cu,分别位于第四周期第ⅥB和第四周期第IB,所以位置如图所示。
(4)根据周期表的结构可知,第六周期和第七周期原子序数相差32。由于第六周期的0族元素的原子序数是86,所以如果把第七周期排满,则元素周期表共可以排布118元素.
(5)非金属性越强,电负性越大。由于非金属性最强的是F,所以电负性最大的元素是F。根据构造原理可知,其轨道表达式是 ;单质氟能和水反应生成氧气,反应的化学方程式是2F2+ 2H2O ="==" 4 HF + O2。
;单质氟能和水反应生成氧气,反应的化学方程式是2F2+ 2H2O ="==" 4 HF + O2。
