金属与人类的生产生活息息相关。
(1)下列金属制品中,利用金属导电性的是_________(填字母序号)。



A.铁锅 B.铜导线 C.水龙头
(2)金属腐蚀造成资源浪费,铁生锈的条件是 。
(3)应用金属活动性顺序能帮助我们进一步学习金属性质。已知下列各组物质间均能发生化学反应。
A.Fe和CuSO4溶液 B. Mg和MnSO4溶液 C. Mn和FeSO4溶液
①写出Fe和CuSO4溶液反应的化学方程式 。
②以上四种金属的活动性由强到弱的顺序是 。
(4)化学小组对含有硫酸铜和硫酸锌的废液进行了如下处理:
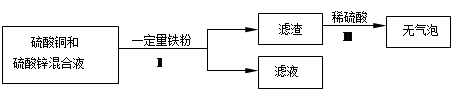
①步骤Ⅰ中的操作名称是___________。
②滤液的成分是 (写出所有可能)。
(1)B (2)接触潮湿的空气(氧气和水共同接触) (3)①Fe + CuSO4 = FeSO4 + Cu
② 镁>锰>铁>铜(4)①过滤 ②硫酸锌、硫酸亚铁或硫酸锌、硫酸亚铁、硫酸铜
题目分析:(1)A.铁锅是利用铁的传热性,故A不符合题意;B.铜导线是利用铜的导电性,故选B;C.水龙头是利用金属的硬度,韧性,故C不符合题意;(2)金属腐蚀造成资源浪费,铁生锈的条件是接触潮湿的空气(氧气和水共同接触);(3)①写出Fe和CuSO4溶液反应的化学方程式①Fe + CuSO4 = FeSO4 + Cu,②A.Fe和CuSO4溶液反应得出铁的金属性比铜强,B. Mg和MnSO4溶液反应得出镁的金属性比锰强,C. Mn和FeSO4溶液反应得出锰的金属性比铁强,故四种金属的活动性由强到弱的顺序是镁>锰>铁>铜;(4)①步骤Ⅰ中的操作名称是过滤,②因为滤渣中加稀硫酸无气泡产生,说明铁已完全反应,锌的金属性比铁强,所以滤液中一定有硫酸锌,如果铁盒硫酸铜溶液恰好完全反应,那么滤液中有硫酸锌、硫酸亚铁,如果硫酸铜过量,那么滤液中有硫酸锌、硫酸亚铁、硫酸铜,故滤液的成分是硫酸锌、硫酸亚铁或硫酸锌、硫酸亚铁、硫酸铜。
