问题
选择题
下面均是正丁烷与氧气反应的热化学方程式(25℃,101 kPa):
①C4H10(g)+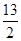 O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-2 878 kJ·mol-1
②C4H10(g)+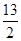 O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
O2(g)===4CO2(g)+5H2O(g) ΔH=-2 658 kJ·mol-1
③C4H10(g)+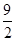 O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
O2(g)===4CO(g)+5H2O(l) ΔH=-1 746 kJ·mol-1
④C4H10(g)+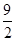 O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
O2(g)===4CO(g)+5H2O(g) ΔH=-1 526 kJ·mol-1
由此判断,正丁烷的燃烧热是 ( )
A.ΔH=-2 878 kJ·mol-1
B.ΔH=-2 658 kJ·mol-1
C.ΔH=-1 746 kJ·mol-1
D.ΔH=-1 526 kJ·mol-1
答案
答案:A
题目分析:燃烧热是在101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,正丁烷生成的物质是CO2(g)和H2O(l),应用反应①计算。故A正确。
