(12分)已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | |
| X的数值 | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 |
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断BeCl2中的化学键类型是 。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性之间的关系 ;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系 。
(3)某化合物分子中含有S—N键,你认为该共用电子对偏向于 原子(填元素符号)。
(4)写出O原子的电子排布图
(5)Cl元素的最高正价为 ,其最高价氧化物的水化物的化学式为 。
(6)若要鉴定某化合物中是否含有S元素,需用 的方法;若要确定C2H6O的结构,需用 的方法,分子式为C2H6O的两种不同的结构简式分别为 , ,这两种结构互为 。
.(1)共价键 (2)X越大,金属性越弱;X越大,半径越小 (3)N
(4)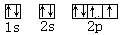 (5)+7,HClO4 (6)原子光谱,质谱,
(5)+7,HClO4 (6)原子光谱,质谱,
CH3CH2OH,CH3-O-CH3,同分异构体
(1)根据表中数据可知,X应该是元素的电负性。由于氯元素和Be元素的电负性形成1.3,所以氯化铍中化学键是共价键。
(2)根据元素的电负性可知,F元素的电负性最大,钠元素的电负性最小,所以电负性越大,金属性越弱,非金属性越强;由于第二周期中F元素的原子半径最小,而Li的原子半径最大,即同周期自左向右原子半径是逐渐减小的,所以电负性越大,原子半径越小。
(3)非金属性越强,电负性越大,所以氮元素的电负性大于碳元素的,即大于2.5,所以氮元素的电负性也大于S元素的,N-S键中共用电子对偏向氮元素。
(4)根据构造原理可知,氧元素的电子排布图是 。
。
(5)氯元素是第ⅦA元素,所以最高价是+7价,则最高价氧化物的水化物的化学式是HClO4。
