(l2分)下表是元素周期表的一部分,根据所给的10 种元素,回答下列
问题。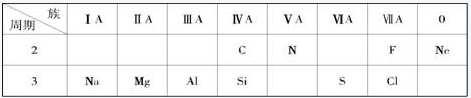
(1)非金属性最强的元素是 ;
(2)Ne 原子结构示意图为 ;
(3)C 与N 中,原子半径较小的是 ;
(4)氯水具有漂白作用,是由于其中含有 (填“HCl”或“HClO”)
(5)元素最高价氧化物对应的水化物中,碱性最强的是 (填化学式),呈两性的是 (填化学式);
(6)元素硅的氧化物常用于制造 (填一种高性能的现代通讯材料的
名称);
(7)右图 为某有机物的球棍模型(其中
为某有机物的球棍模型(其中 代表氢原子代表
代表氢原子代表 碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)= 。(相对原子质量C-12、H-l)
碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)= 。(相对原子质量C-12、H-l)
(8)镁是制造汽车、飞机、火箭的重要材料。写出工业上电解熔融氯化镁获得金属镁的化学方程式 。
(l)F或氟 (2) 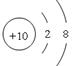
(3)N (4) HClO (5)NaOH Al(OH)3
(6)光导纤维 (7)6:l (8) MgCl2 Mg+Cl2↑
Mg+Cl2↑
题目分析:(1)根据元素周期表可知,非金属性最强的元素是F。
(2)Ne的原子序数是10,所以原子结构示意图为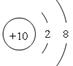 .
.
(3)同周期自左向右原子半径是逐渐减小的,所以C 与N 中,原子半径较小的是N。
(4)氯气溶于水生成的次氯酸具有漂白性
(5)金属性越强,最高价氧化物的水化物的碱性越强,所以碱性最强的是氢氧化钠。而氢氧化铝是两性氢氧化物。
(6)元素硅的氧化物二氧化硅常用于制造光导纤维。
(7)根据模型可知该有机物是乙烯(CH2=CH2),其中碳元素与氢元素的质量比m(C):m(H)=24︰4=6:l。
(8)镁是活泼的金属,应该用电解法冶炼,所以工业上电解熔融氯化镁获得金属镁的化学方程式是MgCl2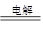 Mg+Cl2↑。
Mg+Cl2↑。
点评:本题的根据是熟练掌握元素周期表的结构以及元素周期律,不能灵活运用。
