问题
选择题
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
答案
答案:B
题目分析:A.因为同一反应在相同的温度下的平衡常数不变,故容器①、②中反应的平衡常数相等,正确;B.容器②中反应可视为是容器①已经反应了一部分,故达到平衡时放出的热量Q<23.15kJ,原说法不正确;C.容器①、②中达平衡时的等效的,由①可知生成n(XY3)=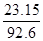 ×2mol=0.5mol,故c(XY3)=
×2mol=0.5mol,故c(XY3)=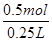 =2 mol·L-1,正确;D.若容器①体积为0.20 L,相当于原反应缩小体积,加压,平衡正向移动,故放出的热量大于23.15 kJ,正确。
=2 mol·L-1,正确;D.若容器①体积为0.20 L,相当于原反应缩小体积,加压,平衡正向移动,故放出的热量大于23.15 kJ,正确。
