问题
填空题
(6分)四种短周期元素的微粒信息如下表:
| 元素代号 | Q | R | X | Z |
| 微粒信息 | 离子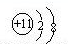 | 单质分子R2 | 离子:X3+ | 一种原子816Z |
(1)Q位于周期表第----周期----族。化合物Q2Z的电子式为 (元素符号表示)
(2)Q、R、X的原子半径由大到小的顺序为 。Q、R、X、Z中金属性最强的是 (元素符号表示)
(3)Q与X两者的最高价氧化物对应的水化物之间发生反应的离子方程式为
答案
(1)三 ⅠA族  (2)Na>Al>Cl Na(3)Al(OH)3+OH-=AlO2-+2H2O
(2)Na>Al>Cl Na(3)Al(OH)3+OH-=AlO2-+2H2O
题目分析:Q质子数为11,为Na; Q、R、X在同一周期,R2在常温常压下为气态,R为Cl,X为Al;Z质子数为8,为O。
(1)钠位于第三周期第IA族,氧化钠电子式为 。
。
(2)Na、Al、Cl同处于第三周期,从左向右原子半径减小,原子半径Na>Al>Cl。金属性Na>Al>S>Cl、S>O,所以四种元素中金属性最强的是Na。
(3)Na与Al最高价氧化物对应水化物分别是氢氧化钠和氢氧化铝,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
点评:熟记1~18号元素名称和元素符号。
