(共15分)(9分)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素名称为 ;五种元素的原子半径从小到大的顺序是(用元素符号表示) 。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程 ,B的结构式 。
(3)硒(Se)是人体必须的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ,其最高价氧化物对应的水化物化学式为 。该族2~5周期元素单质分别与H2反应生成1 mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是 (填字母代号)。
a.+99.7 kJ·mol-1 b.+29.7 kJ·mol-1 c.-20.6 kJ·mol-1 d.-241.8 kJ·mol-1
(4)一定条件下,M与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知。该反应生成lmol乙时放出536kJ热量,其热化学方程式为
(1)氧(1分) 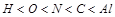 (1分)
(1分)
(2)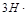 +
+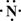
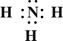 (1分)
(1分) 
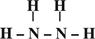 (1分)
(1分)
(3)34(1分) 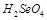 (1分) b(1分)
(1分) b(1分)
(4) =
=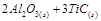
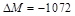 g/mol(2分)
g/mol(2分)
题目分析:根据Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素,可知Z、L一个是氧一个是氮,M是铝。Y原子的最外层电子数是次外层电子数的两倍,所以Y为C,X的阴离子电子数为2,所以X是氢,而由于Z、X两元素按原子数目比1:3和2:4构成分子A和B,所以Z是氮,形成的A是氨气,而L是氧,X是氢。(1)问中原子半径比较,电子层数越多半径越大,如果电子层数相同,则核电荷数越大半径越小,所以半径比较为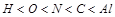 ;(2)中A为NH3,B为N2H2;(3)Se的原子序数比L,即O的多两个电子层,多26个电子,为34个。最高价为正六价,与硫酸相似,可以写出
;(2)中A为NH3,B为N2H2;(3)Se的原子序数比L,即O的多两个电子层,多26个电子,为34个。最高价为正六价,与硫酸相似,可以写出
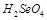 ;在2~5周期元素第六主族中,Se非金属性比O、S弱,氢化物稳定性比O、S弱,氢化物的能量也比O、S的低,位居第三位。(4)根据反应物与生成物写反应方程式,配平。热化学方程式需标注物质状态,和反应热。
;在2~5周期元素第六主族中,Se非金属性比O、S弱,氢化物稳定性比O、S弱,氢化物的能量也比O、S的低,位居第三位。(4)根据反应物与生成物写反应方程式,配平。热化学方程式需标注物质状态,和反应热。
点评:本题以元素周期表各元素推断作为背景,穿插了很多其他的知识,综合性较强,难度一般。
