问题
填空题
(1)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+ 2H2O(g)  CO2(g)+4H2(g)
CO2(g)+4H2(g)
反应过程中能量变化如图所示,
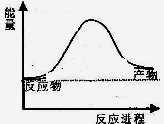
则该反应为 反应(填“吸热”或“放热”)
若已知,破坏1mol化学键需要吸收的热量如下表所示:
| 化学键 | C—H | O—H | C=O | H—H |
| 吸收热量(kJ/mol) | a | b | c | d |
(2)某温度下,10L密闭容器中充入2mol CH4和3mol H2O(g),发生
CH4(g)+ 2H2O(g)  CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
CO2(g)+4H2 (g)反应, 反应进行到4s时CO2的浓度为0.08mol/L,再过一段时间反应达平衡,平衡时容器的压强是起始时的1.4倍。
则 ① 前4s以H2O(g)浓度变化表示的平均反应速率为多少?②4s时,混合气体中H2的体积分数为多少?③ 平衡时,CH4的浓度是多少?
(要求:写出计算过程)
答案
(1)吸热;4a+4b-2c-4d
(2)
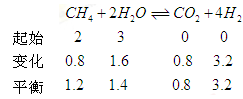
①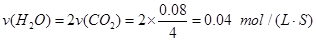
②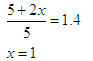
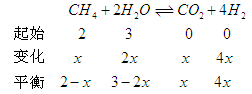
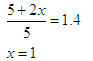

题目分析:(1)由能量转化关系图可知反应物能量低于生成物浓度,故该反应为吸热反应;对于反应CH4(g)+ 2H2O (g)  CO2(g)+4H2(g),破坏反应物中化学键需吸收能量为4a+4b,形成生成物中化学键可释放能量为2c+4d,则该反应吸收的热量为4a+4b-2c-4d;(2)利用三段式进行计算。
CO2(g)+4H2(g),破坏反应物中化学键需吸收能量为4a+4b,形成生成物中化学键可释放能量为2c+4d,则该反应吸收的热量为4a+4b-2c-4d;(2)利用三段式进行计算。
