已知盐酸是HCl气体溶于水所形成的溶液。在实验室制取二氧化碳并检验其性质的实验中,如果用浓盐酸代替稀盐酸,并将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象。现有一同学用下列装置进行实验,却看到了澄清石灰水变浑浊的现象。回答下列问题:
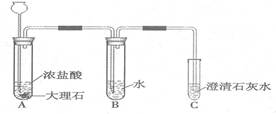
(1) A 装置中发生反应的化学方程式是 。
(2)B装置的作用是 。实验后向B中滴入石蕊溶液可看到的现象是 ,写出B中所有溶质的化学式 ;
(3)如果去掉B装置,将A与C直接相连,则C装置中可能发生反应的化学方程式为 。
⑴ CaCO3+2HCl=CaCl2+CO2↑+H2O
⑵ 除去氯化氢气体 石蕊变红 HCl、H2CO3
⑶ Ca(OH)2+2HCl=CaCl2+2H2O
题目分析:(1)A 装置中的药品是大理石和盐酸,反应的化学方程式是:CaCO3+2HCl=CaCl2+CO2↑+H2O
(2)由于浓盐酸具有挥发性,这样使得二氧化碳气体中混有氯化氢气体,而氯化氢气体易溶于水,故B装置中水的作用是:除去氯化氢气体,得到盐酸,能使紫色石蕊溶液变红,故实验后向B中滴入石蕊溶液可看到的现象是:石蕊变红,B中所有溶质的化学式:HCl还有二氧化碳与水反应形成的H2CO3
(3)如果去掉B装置,将A与C直接相连,即产生的二氧化碳气体中混有氯化氢气体,将产生的气体通入澄清的石灰水,往往看不到溶液变浑浊的现象,则C装置中可能发生反应的化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O
