(14分)W、X、Y、Z是四种常见的短周期元素,其原子序数依次增大,其它相关信息如下表所示

(1 )X位于元素周期表中第________周期第_____族;Y基态原子的电子排布式为_______。
(2)在W-H、X-H两种共价键中,键的极性较强的是_______,元素Y与W按原子个数比1 : 3形成的化合物所属的晶体类型是_______。
(3)W的一种氢化物(W2H4)与W2X4发生反应: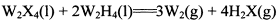 ,反应中若形成
,反应中若形成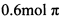 键放热103.9k!。则该反应的
键放热103.9k!。则该反应的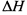 =_______。
=_______。
(4)元素X、Y、Z可形成1:1:1型化合物A,已知A在热的碱性溶液中分解得到物质的量之比为1 : 2的两种盐,写出该反应的化学方程式_______。
(1)二(1分) ⅥA(1分) 1s22s22p63s1(2分)
(2)O-H(或X-H) (2分)离子晶体(2分)
(3)–1039kJ∙ mol-1 (3分)
(4)3NaClO  NaClO3 + 2NaCl (3分)
NaClO3 + 2NaCl (3分)
考察物质结构元素周期律及推理能力。
因为 W基态原子中s电子数比p电子数多1,电子排布式是1s22s22p3,即W为N; X的原子最外层电子数是其内层电子数的3倍,为O;由短周期元素、原子序数依次增大和Y的第一电离能在同周期元素中最小,可知Y为Na;Z一种核素的质量数为37,中子数为20 ,可知Z的质子数为17,即Z为Cl。
(1)X为O,位于元素周期表中第二周期第ⅥA族;Y为Na,基态原子电子排布式为1s22s22p63s1。
(2)O的电负性比N大,在N-H、O-H两种共价键中O-H的极性较强,元素Y与W按原子个数比1:3形成的化合物为NaN3,所属的晶体类型是离子晶体。
(3)1molN2中π键为2mol每形成0.6molπ键相当于生成0.3 molN2,根据计算得ΔH =–1039kJ∙ mol-1。
