(12分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。
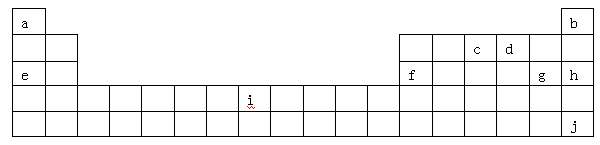
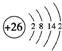
(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图__________。
(2)由以上元素形成的金属单质中,熔点最低的是__ __。(填元素符号)
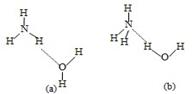
(3)NH3·H2O的电离方程式为NH3·H2O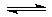 NH4++OH-,试判断NH3溶于水后,右图中形成的NH3·H2O的合理结构是________(填序号)。
NH4++OH-,试判断NH3溶于水后,右图中形成的NH3·H2O的合理结构是________(填序号)。
(4)a位于第ⅠA族,有人认为a也可以放在ⅦA族,下列物质能支持这种观点的是
A.HF
B.H3O+
C.NaH
D.H2O2(5)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是_________(填写字母)。
(6)利用稀有气体化合物,人们实现了许多制备实验上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出该反应的方程式:
(1) (2)e (3)(b) (4)C (5)j (6)
(2)e (3)(b) (4)C (5)j (6) 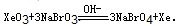
题目分析:根据元素在周期表中的分布,可以知道:a是H,b是He,c是N,d是O,e是Na,f是Al,g是Cl,h是Ar,i是Fe,j是Xe.
(1)Fe是26号元素,原子结构示意图为: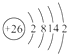 ,故答案为:
,故答案为: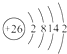 ;
;
(2)钠和铝中,熔点最低的是Na,故答案为:Na;
(3)NH3溶于水后,形成的NH3•H2O中,根据NH3•H2O的电离方程式为NH3•H2O NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,故答案为:(b);
NH4++OH-,可知结构中含有铵根和氢氧根的基本结构,故答案为:(b);
(4)因首先被用来与F2反应制备稀有气体化合物的元素的性质最活泼,而稀有气体化学性质相对稳定,从上至下,稀有气体元素金属性增强,相对来说易失去电子,所以最先制得j的氟化合物,故答案为:j;
(5)根据信息可知:反应物有XeO3和NaBrO3,生成物有NaBrO4和Xe,结合氧化还原电子得失配平可知:XeO3+3NaBrO3═3NaBrO4+Xe,故答案为:XeO3+3NaBrO3═3NaBrO4+Xe↑;
(6)氯化氢是含有H-Cl共价键的共价化合物,故答案为:共价.
点评:本题考查学生元素周期表中的基本知识,题目设置难度较高,综合性较强。
