(12分)A、B、C是中学化学中常见的三种短周期元素。已知:①A元素原子最外层电子数是次外层电子数的2倍;②B元素最高正价与最低负价的代数和为2;③C元素有多种化合价,且常温下C元素的单质与石灰水反应,可得到两种含C元素的化合物;④B、C两种元素质子数之和是A元素质子数的4倍。
(1)写出常温下C的单质和石灰水反应的离子方程式____________________ ;
两者恰好反应所得溶液中各种离子浓度由大到小的顺序是 。
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的B4气态分子。B4分子结构与白磷分子结构相似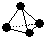 ,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。写出B4转化为B2的热化学方程式: ;
,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。写出B4转化为B2的热化学方程式: ;
由此判断相同条件下B4与B2的稳定性顺序是:_____________ _。(以上均用化学式表示)
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。写出X的电子式: ;
X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是______________ _。
(共12分)
(1)C12+2OH-=ClO-+H2O + Cl- c(Ca2+)=c(Cl-)>c(ClO-)>c(OH-)>c(H+) (各2分)
(2)N4(g) =2N2(g) △H=-882kJ·mol-1 N2>N4 (各2分)
(3) 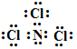 NCl3 + 3H2O =NH3↑+ 3HClO (各2分)
NCl3 + 3H2O =NH3↑+ 3HClO (各2分)
题目分析:根据短周期元素,A元素原子最外层电子数是次外层电子数的2倍,则A为碳元素;B元素最高正价与最低负价的代数和为2,则B为氮或磷元素;再由③C可能为氯元素,由④A元素质子数的4倍为6×4=24,B的质子数为24-17=7,即B为氮元素,最后利用元素形成的物质的性质及结构来解答即可。
由短周期元素,A元素原子最外层电子数是次外层电子数的2倍,则A为碳元素;B元素最高正价与最低负价的代数和为2,则B为氮或磷元素;再由③C可能为氯元素,由④A元素质子数的4倍为6×4=24,B的质子数为24-17=7,即B为氮元素。
(1)因C为氯元素,氯气与石灰水反应生成氯离子和次氯酸根离子和水,离子方程式为C12+2OH-=ClO-+Cl-+H2O,故答案为:C12+2OH-=ClO-+Cl-+H2O;
(2)因B为氮元素,断裂1molB-B吸收167kJ的热量,生成1molB≡B放出942kJ热量,则N4(g)═2N2(g)的△H="167×6-2×942=-882" kJ/mol,
故答案为:N4(g)═2N2(g)△H=-882kJ/mol;
(3)B为氮元素、C为氯元素,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构,则两种元素组成的化合物X为NCl3,结构中存在三个
N-Cl共价单键,其结构式为 ,由X遇水蒸气可形成一种常见的漂白性物质及元素守恒可知反应为NCl3+3H2O═NH3+3HClO,
,由X遇水蒸气可形成一种常见的漂白性物质及元素守恒可知反应为NCl3+3H2O═NH3+3HClO,
故答案为: ;NCl3+3H2O═NH3+3HClO;
;NCl3+3H2O═NH3+3HClO;
点评:本题以元素的位置、结构、性质为信息来考查元素的推断,然后利用元素组成的物质的性质来解答,明确物质的性质、反应热的计算、晶体类型与性质的关系等即可解答,综合性强,符合高考的命题方向。
