(10分)下表是部分短周期元素的原子半径及主要化合价:
| 元素代号 | W | R | X | Y | Z | Q | M |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 | 0.150 | 0.160 |
| 主要化合价 | +1 | +1 | -2 | -3、+5 | +2、+4 | +3 | +2 |
(1)七种元素中原子半径最大的元素在周期表中位置是 。
M在Z的最高价氧化物中燃烧的化学方程式 。
(2)X可与W组成含18电子的化合物甲,甲的电子式为 ;R与X形成化合物乙R2X,用电子式表示乙的形成过程_____________________________
(3)写出Q与R最高价氧化物对应水化物反应的离子方程式_____________________。
(4)Y的氧化物是主要大气污染物之一,写出一种与之有关的污染现象______________。
(1)第三周期第IA族(1分) 2Mg+CO2 2MgO+C
2MgO+C
(2)
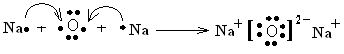
(3)2Al+2OH—+2H2O=2AlO2—+3H2↑
(4)光化学烟雾(或硝酸型酸雨、臭氧空洞)(1分)
题目分析:根据化合价可知,W、R为第ⅠA族元素,W可能是H,也可能是Li,如是Li,与X、Y、Z原子半径在同一级数,则在同一周期,同一周期元素原子半径从左到右逐渐减小,而W原子半径最小,则W只能为H元素,R为Na元素,X、Y、Z原子在第二周期,根据化合价,X为第ⅥA族元素,应为O元素,Y为第ⅤA族元素,根据半径大小可知,Y应为N元素,Q为Al元素,Z为第ⅣA族元素,应为C元素,M为第ⅡA族元素,应为Mg元素。
(1)七种元素中原子半径最大的元素为Na元素,原子序数为11,原子核外有3个电子层,最外层电子数为1,则在第三周期IA族,M在Z的最高价氧化物中燃烧为Mg在CO2中反应,生成MgO和C,反应方程式为2Mg+CO2 2MgO+C,
2MgO+C,
故答案案为:第三周期IA族;2Mg+CO2 2MgO+C;
2MgO+C;
(2)X可与R按1:1的原子个数比形成化合物甲,应为Na2O2,存在离子键和共价键,X可与W组成含18电子的化合物乙,为H2O2,电子式为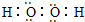 ,
,
故答案为:离子键和共价键;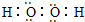 。
。
(3)Q与R分别为Al和Na元素。
(4)Y是NO2,NO2造成的环境污染为:光化学烟雾、或硝酸型酸雨、臭氧空洞。
点评:本题考查物质结构和性质的相互应用,题目难度较大,注意从化合价推断和原子半径推断元素的种类,能了解常见化合物的结构和性质。
