问题
填空题
某元素的同位素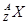 ,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的
,它的氯化物XCl2 2.22g溶于水制成溶液后,加入2mol/L的
AgNO3溶液20ml恰好完全反应,若这种同位素原子核内有20个中子,求:
(1)A=
(2)X元素在周期表中的位置? ,XCl2的化学式: 。
答案
(3分 )(1)40;(2)第四周期第IIA主族;CaCl2
题目分析:(1)硝酸银的物质的量是2mol/L×0.02L=0.04mol
则根据方程式Ag++Cl-=AgCl↓可知
氯化物中氯离子的物质的量是0.04mol
则该氯化物的物质的量是0.02mol
则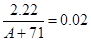
解得A=40
(2)Z=40-20=20
因此X是Ca,位于第四周期第ⅡA族
该氯化物的化学式是CaCl2
点评:该题是基础性试题的考查,难度不大。试题注重基础知识的巩固和解题方法的指导,有利于培养学生的逻辑思维能力和规范答题能力。
