下图是中学教材中元素周期表的一部分,试回答下列问题:
| ① | ||||||||||||||||||||||||
| ② | ③ | ④ | ⑤ | |||||||||||||||||||||
| ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | 11 | |||||||||||||||||||
| 12 | 13 | |||||||||||||||||||||||
| 14 | 15 | |||||||||||||||||||||||
①性质 最不活泼的是 ;
②原子半径最小的是(除稀有气体元素) _ 。简单阴离子半径最大的是 。
③形成的气态氢化物最稳定的是 ;
④最高价氧化物对应的水化物酸性最强的是 ,
⑤在⑤⑩15三种元素形成的阴离子中还原性最强的是 ,
⑥可作半导体的是 (填表中编号)
(2)用电子式表示②与④形成的化合物的形成过程 __。
(3)⑨与12形成的化合物溶于水所克服的微粒间作用力为 。
(4)13在元素周期表中的位置是 ,元素③形成的单质的结构式为 。
(5)________(填化学式)的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式是___________________________________________。
(6) “神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的___ _(填表中编号)元素组成的,用化学方程式表示吸收原理:_________________ ______ 。
(7)设②的原子序数为Z,则14的原子序数为 (用Z表示)。
考查知识点:根据元素周期表,①比较金属性,非金属性,对应粒子还原性及半径的大小;②判断元素在周期表的位置;③化学键 ④位置确定序数;⑤位置推测用途
(1)①Ar ②H; I- ③HF; ④HClO4, 15I- ⑥ ⑧和13
(2)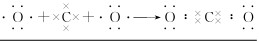
(3)离子键 (4)第四周期 IVA N≡N
(5)Al 2Al+2OH-+2H2O=2AlO2-+3H2↑
(6) ④⑥ 2Na2O2+2CO2===2Na2CO3+O2
(7)Z+44
题目分析:(1)在上表所列出的短周期元素中性质最不活泼的是稀有气体①Ar;②原子半径最小的是(除稀有气体元素)H;简单阴离子半径最大的是I-。③形成的气态氢化物最稳定的是HF。④最高价氧化物对应的水化物酸性最强的是HClO4。⑤、在⑤⑩15三种元素形成的阴离子中还原性最强的是15I-。⑥可作半导体的应该是处在元素周期表中金履元素与非金属元素的交界处,故只有⑧和13可作为半异体。
(2)②与④分别为C、O,用电子式表示②与④形成的化合物的形成过程: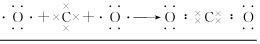

(3)⑨与12形成的化合物为NaCl,属于离子化合物,溶于水所克服的微粒间作用力为离子键。
(4)13在元素周期表中的位置是第四周期 IVA,元素③形成的单质的结构式为N≡N。
(5)既可以和盐酸又可以和氢氧化钠溶液反应的单质是Al,与氢氧化钠溶液反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑。
(6) CO2应该是由上表中的④⑥元素组成的,用化学方程式表示吸收原理:2Na2O2+2CO2===2Na2CO3+O2
(7)设②的原子序数为Z,而14在元素周期表的位置是第五周期第IVA,则的原子序数为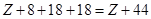
点评:元素周期表是历年高考的重点和难点,其涉及的内容知识面比较广,综合性较强,考查学生对元素周期表的整体了解,掌握情况,侧重培养学生逻辑思维能力和解决实际问题能力 。
