甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有广泛的开发和应用前景.以CH4和H2O为原料制备二甲醚和甲醇的工业流程如下:
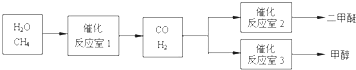
请填空:
(1)工业上一般采用下列两种反应成甲醇:
反应Ⅰ:CO(g)+2H2(g)═CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2
上述反应符合“原子经济”原则的是______(填“Ⅰ”或“Ⅱ”).
(2)在一定条件下,已知反应室2的可逆反应除生成二甲醚外还生成了气体CO2,其化学方程式为______.
(3)若利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)⇌CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
则反应:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)△H=______kJ/mol.
(4)某实验小组依据甲醇燃烧的反应原理,设计如图1所示的电池装置.则该电池正极的电极反应为:______.
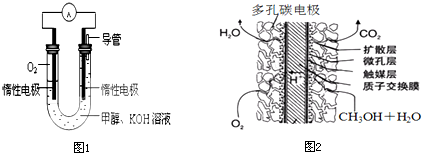
(5)甲醇质子交换膜燃料电池(如图2所示)是以酸性溶液为电解质溶液,甲醇从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入甲醇的一极电极反应式为:______.
(1)化合反应的原子利用率最高,为100%,故答案为:Ⅰ;
(2)已知反应室2的可逆反应除生成二甲醚外还生成了气体CO2,其化学方程式为3CO+3H2⇌CH3OCH3+CO2,故答案为:3CO+3H2⇌CH3OCH3+CO2;
(3)①2H2(g)+CO(g)⇌CH3OH(g)△H=-90.8kJ•mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ•mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.3kJ•mol-1
依据盖斯定律②+③+①×2得到3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2 (g)△H=-246.4KJ/mol;
则反应热化学方程式为:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2 (g)△H=-246.4KJ/mol
故答案为:-246.4;
(4)甲醇燃烧的反应原理是:正极反应一定是氧气得电子的过程,在碱性环境下,得到氢氧根离子,即O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(5)以酸性溶液为电解质溶液,甲醇从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入甲醇的一极电极反应式为CH3OH+H2O-6e-═6H++CO2,
故答案为:CH3OH+H2O-6e-═6H++CO2.
