主族元素R的最高价氧化物R2O 4.7g溶于95.3g水中,所得溶液的质量分数为5.6%,R原子核中含有20个中子;主族元素Q,其单质能与水剧烈反应放出O2,并能跟R形成典型的离子化合物RQ。试通过计算求:
(1)R和Q各为什么元素(写出推导过程);________________________________________。
(2)写出R和Q在元素周期表中的位置;________________________________________。
(3)将4.7g R2O溶于多少克水中,使每50个水分子溶有1个R+(写出计算过程)。________________________________________。
(1)R为K元素,Q为F元素。
(2)R在第4周期ⅠA族,Q在第2周期ⅦA族。
(3)90.9g
题目分析:(1)设R的相对原子质量为M,生成ROH的质量为x。
R2O+H2O === 2ROH
2M+16 2(M+17)
4.7g x
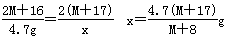
w(ROH)= ×100%=5.6%
×100%=5.6%
M=39。则R原子核内质子数为39-20=19,为K。又因Q能与水反应置换O2,并能跟R形成离子化合物RQ,则Q为-1价元素,为ⅦA族,则Q为F。
(2)R在第4周期,ⅠA族;Q在第2周期,ⅦA族。
(3)K2O +H2O===2KOH
94g 18g 2mol
4.7g m(H2O) n(KOH)

共需水:0.9g+0.1mol×50×18g/mol=90.9g。
点评:本题考查的是元素周期表的应用和化学计算的性质,题目难度中,考查学生对周期表的掌握程度及化学计算的能力。
