A~D为短周期元素,其性质或结构信息如下表所示:
| 元素 | A | B | C | D |
| 相关 信息 | 其单质是一种本身有毒又可用来消毒的有色气体 | 其单质既有金属性,又有一定的非金属性(但属于金属) | 其最外层电子数是电子层数的2倍,且能形成熔点高硬度大的稳定单质 | 其简单离子核外电子层结构与Ar原子电子层结构相同,单质常出现在火山喷口附近或地壳的岩层里 |
(1)A元素在元素周期表中的位置是________,能说明A单质与D单质氧化性相对强弱的离子方程式为__________________________。
(2)B的单质与大多数同类的物质相比较在化学性质上有一些不同之处,请说明其中一点(用文字或化学方程式表述)__________________________ _。
(3)A与C形成化合物的电子式为______________________。
(4) B和D形成的化合物只能用干法制取,写出该方法的化学方程式___________。
(10分)
(1)第三周期ⅦA族 Cl2+S2-===2Cl-+S↓(其他合理答案也可) (每空2分,共4分)
(2)2Al+2NaOH+2H2O===2NaAlO2+3H2↑(或答:铝热反应,铝在冷的浓硫酸或浓硝酸中钝化等) (2分)
(3)(2分)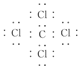 (4) 2Al+3S
(4) 2Al+3S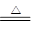 Al2S3 (2分)
Al2S3 (2分)
题目分析:单质是一种本身有毒又可用来消毒的有色气体,则A是氯元素。单质既有金属性,又有一定的非金属性(但属于金属),所以B是铝。最外层电子数是电子层数的2倍,且能形成熔点高硬度大的稳定单质,则C是碳元素。简单离子核外电子层结构与Ar原子电子层结构相同,单质常出现在火山喷口附近或地壳的岩层里,所以D是硫元素。
(1)氯元素的原子序数是17,则在元素周期表中的位置是第三周期ⅦA族。比较元素非金属性强弱可以利用置换反应判断,即强置弱,则反应的方程式是Cl2+S2-===2Cl-+S↓。
(2)金属一般不能和氢氧化钠溶液反应生成氢气,但铝可以。再就是铝可以发生铝热反应,铝也可以在冷的浓硫酸或浓硝酸中钝化。
(3)碳元素与氯元素形成的四氯化碳是含有极性键的共价化合物,电子式为
(4)制备硫化铝的方程式是2Al+3S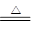 Al2S3。
Al2S3。
点评:该题是高考中额常见题型,属于中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。
