短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
(2) D在周期表中的位置为 ________________;
(3)B和C简单离子的半径大小为________>_______;(用离子符号表示)
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是_______(填序号);
a.比较两种单质的颜色
b.比较氢化物的稳定性
c.依据两元素在周期表中的位置
d.依据两元素单质在自然界中的存在状态
(5)C和E形成的化合物是 ,所含的化学键的类型为 。
(1) 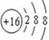 ;
;
(2) __第3周期ⅢA族___________;
(3) O2-___>__Na+;(用离子符号表示)
(4) _a d__(填序号);
(5)Na2S 离子键
题目分析:A、B、C、D、E的原子序数依次增大,B的最外层电子数是内层电子数的3倍,则B是O;A的最高正价和最低负价的绝对值之差为2,A是N;C:1molC单质能与冷水反应,在标准状况下生成11.2LH2,C是Na;D的原子最外层电子数等于其周期序数,D是Al;E的负二价阴离子的电子层结构与Ar原子相同,E的S。
(1) E的简单离子的S原子最外层得到2个电子形成的结构。
(3)核外电子排布相同的阳离子和阴离子,离子的半径核电核数的越大,半径越小。
(4)物质的颜色和状态都是物理性质,无法判断非金属性的强弱,故选ad。
(5)Na是活泼的金属元素,S是活泼的非金属元素,之间易形成离子键。
点评:本题考查原子结构与元素周期律知识,题目难度中等,原子的结构特征是推断元素的种类常考查的角度,学习中注意相关知识的积累。
