登山队员常利用氢化钙(CaH2)固体提供能源,氢化钙和水接触很快反应生成氢气供燃烧之需[CaH2+2H2O=Ca(OH)2+H2↑].
(1)请问:登山队员用氢化钙(CaH2)固体提供能源的优点有:_________.
(2)请你计算:
①CaH2中氢元素的质量分数为多少?
②当登山队员需用氢气80g时,需用多少克CaH2与水完全反应才能获得?
③若氢化钙固体中CaH2的纯度为90%,实际消耗不纯的氢化钙固体的质量为多少?
(1)氢化钙是固体,携带方便,与水作用,能很快产生氢气,氢气燃烧,放出的热量很多且产物为水对空气不造成污染.
(2)①解:CaH2中氢元素的质量分数为: =4.76%
=4.76%
②解一:设需用CaH2的质量为x.
CaH+2H2O=Ca(OH)2+H2↑
42 2
x 80g
∴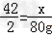 解之得:x=
解之得:x=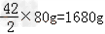
答:需用1680gCaH2与水完全反应.
解二:需用CaH2的质量为: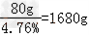
③解:实际消耗不纯氢化钙固体的质量为:
答:若氢化钙固体中CaH2的纯度为90%,实际消耗不纯的氢化钙固体的质量为1866.7g
